
技术文章
TECHNICAL ARTICLES 更新时间:2025-09-02
更新时间:2025-09-02 点击次数:432
点击次数:432
ELISA实验总重复不出?90%新手栽在这里!
ELISA(酶联免疫吸附分析)利用抗原-抗体的免疫反应以及高效催化反应酶的有机结合而发展起来的一种综合性技术,已成为多种生物标志物及生物活性检测中的常客。早在今年2月,本公众号转发了题为酶联免疫吸附测定(ELISA)新手上路:原理、类型及步骤考量的推文,帮大家理清了基础流程。然而许多刚刚接触ELISA实验的小伙伴反馈,尽管对ELISA流程已经背的滚瓜烂熟,但是实验结果总是令人沮丧——批间差异大,批内变异多,明明条件一样,却死活重复不出数据。别急,今天这篇推文聚焦本实验室总结的最关键隐形坑,从操作步骤到影响程度,帮你把问题捋明白,更快上手ELISA!

一、抗原、抗体及分析物的稀释:最关键也最易踩坑
很多人觉得“稀释不就是加液体混匀吗?",但恰恰是这步,藏着导致结果不稳定的核心原因。先给大家举个常见例子:要配制4 mL、工作浓度为2 万倍的抗体稀释液,新手常犯的两种操作,其实都有不小的误差风险。
错误操作1:直接移取极少量原液稀释
不少同学会直接移取0.4 μL抗体原液,加入8 mL PBS中(或0.2 μL原液加入4mL PBS),涡旋混匀后当作2万倍稀释液。
这种操作的问题,出在移液误差上:移液时枪头插入深度、枪头/移液枪的批次差异、反复吹打的次数,都会影响实际移取体积。更关键的是,当移取体积小于1 μL时,误差会被急剧放大——假设移液枪的固有误差是±0.1 μL,移取0.4 μL时误差率就达到±25%,而移取2 μL时误差率仅±5%。这样一来,不同批次配制的2万倍稀释液,实际浓度可能差出一大截,结果自然无法重复。
错误操作2:多次倍比稀释+反复转运
有些同学意识到少剂量的抗体/抗原并不能取准,会选择“分步稀释":先移取2 μL抗体原液到2.5 mL PBS中,涡旋配成2.5千倍稀释液,通过重复倍比稀释步骤,得到2万倍稀释液。
看似“谨慎",但这种方法不仅消耗更多抗体和耗材,还会因抗体的非特异性吸附导致浓度不准。抗体本质是蛋白质,会通过静电作用、疏水作用(非共价键)吸附在EP 管等容器内壁——哪怕 PBS 能维持蛋白结构稳定,也只能轻微减弱这种吸附,无法wanquan避免。更麻烦的是,这种操作要经历3次稀释液转运,每次转运都会有5%-10% 的抗体吸附在容器壁上。按zuidi5% 损失计算,3次转运后,最终稀释液的实际浓度只剩理论值的86%(0.95×0.95×0.95≈0.86);若损失达 10%,多次倍比稀释下的溶液最终浓度甚至会降到目标浓度的六成以下(0.93≈0.73,0.94≈0.66,0.95≈0.59)。
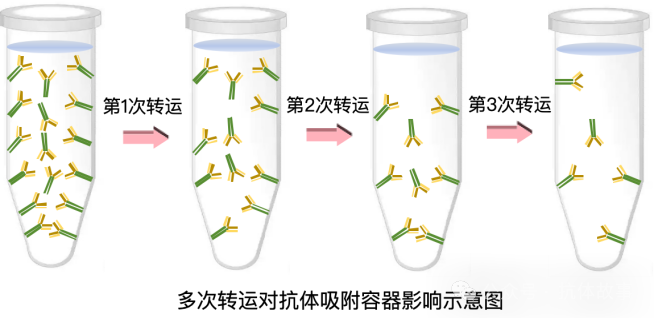
我们也做过对照试验验证:同样是配制2万倍稀释液,4-5次倍比稀释后,实测OD值比直接稀释组下降了近50%。这种稀释步骤的差异,还会导致 “方阵滴定找到的最佳反应量" 与 “后续标曲建立的浓度" 不匹配,进一步放大结果误差。另外要提醒的是,相关研究表明蛋白质的非特异性吸附还受稀释液在容器中的停留时间、环境温度、容器材质的影响,所以实验中必须尽可能统一这些条件。
正确操作:分装冻存+一步稀释,减少误差
1.先分装抗体,避免反复冻融
拿到抗体后,先分成两部分:一部分作为原液分装成小剂量密封冻存(-20℃或-80℃),另一部分加入“冻存保护液"(甘油+PBS,甘油体积占比>30%,防止冻融时蛋白变性),按效价稀释20-200倍备用。这样既能保证批间浓度稳定,也能避免原液意外污染或浪费。
2.低浓度时加BSA,维持蛋白稳定
通常来讲,如果稀释后抗体终浓度低于10 μg/mL,记得在稀释液中加入少量牛血清蛋白(BSA),BSA能模拟抗体的生存环境以充当其在体外储存的“保护剂",减少抗体因浓度过低导致的构象改变,保证反应活性。
3.一步稀释到位,减少转运
还是以配制4 mL 2W倍抗体稀释液为例:直接取20 μL提前稀释好的100倍抗体液,加入4 mL PBS中涡旋混匀即可。
Tips:这里有个小疑问,要不要扣除抗体溶液本身的体积?其实我们认为,只要加入的抗体液体体积不超过总体积的2%(比如4 mL总体系中加20 μL,占比0.5%),对最终浓度的影响可以忽略,不用额外计算。
二、移液枪加样熟练度:别让“手抖" 毁了整板实验
如果说稀释是ELISA 的 “基础工程",那移液枪加样技巧就是决定结果稳定性的关键工序。哪怕导师反复强调移液规范,很多新手还是会忽略:看似简单的吸液-加液,其实藏着影响批内批间差异的大问题。新手常犯的2个加样误区:
1.手抖溅液,贴壁加样救场?
新手加样时容易手抖,导致液体溅出酶标孔外。这时不少人会下意识把移液枪枪头抵住酶标孔壁加样,觉得这样更稳——但这是典型的“错上加错"。
一方面,贴壁加样会让液体顺着孔壁流下,无法快速与孔内已有的靶标/抗原充分混合,导致结合反应不chedi;另一方面,枪头接触孔壁时,可能会把前一孔的液体带到相邻孔,造成交叉污染。最终的结果就是:同一批次内,不同孔的检测值差异显著,数据根本没法用。
2.忽视加样力度与速度,反应体系“失衡"
以间接竞争ELISA为例,shouci加入50 μL PBS或标准品时,液体量通常无法wanquan覆盖酶标板底部。这时候,后续抗体加样的 “冲击力" 就很关键,合适的冲击力能让液体快速混匀,确保反应充分;但如果力度不当,要么混合不匀,要么溅起液体污染孔壁。
更易被忽略的是移液枪性能差异:不同品牌、不同最大量程、不同通道数的移液枪,“一枪到底"时的冲击力wanquan不同。如果重复试验中使用具有差异较大的移液器,结果则会参差不齐。
另外,加样速度也会拉大批间差异。对96孔板用单枪加样时,熟练后需控制在一分半钟以内。如果加样太慢,先加样的孔已经开始反应,后加样的孔才刚接触试剂,相当于不同孔的反应时间差了好几分钟,结果自然无法平行。
正确加样操作:3个关键参数+反复练习
想要掌握稳定的加样技巧,核心是记住这几个要点,再通过反复练习形成肌肉记忆:
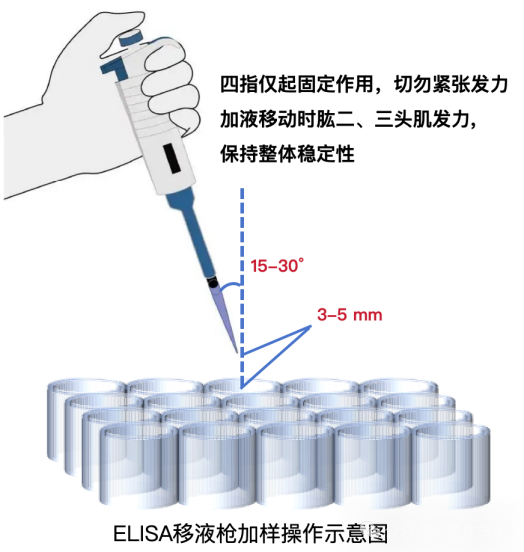
角度:移液枪枪头与垂直方向可保持15-30° 夹角,既避免垂直加样时手指无法稳定发力,也能确保液体精准入孔。
高度:枪头距离酶标孔上沿3-5 mm,不要太高(防止液体溅出),也不要太低(避免接触孔壁污染)。
速度与力度:快速、稳定地将液体注入孔中,利用液体注入的冲击力让孔内组分充分混合(不用额外吹打,避免气泡产生)。
记住:哪怕理论记得再熟,只有通过几百上千次的加样练习,才能做到“手不抖、液不溅、速度稳"。
三、其他“隐形杀手":这些细节最易被忽略
除了稀释和加样,ELISA实验中还有几个 “不起眼" 的细节,实则对结果影响极大,新手往往栽在这些地方。
1.温度
温度对ELISA的影响,体现在实验的每一步:溶液配制、加样、孵育,哪怕是1-2℃的差异,都可能让结果跑偏。对于没有恒温条件的实验室,早中晚室温差异明显(比如早上22℃、中午26℃),直接导致不同批次的反应速率不同;甚至同一批次实验,从冰箱拿出来的试剂没回温就直接用,也会让局部反应温度过低。孵育箱 “位置差":酶标板的摆放位置也会影响加热速度,靠近孵育箱内壁的酶标板升温更快,中间的升温慢,这会加剧“边际效应"(酶标板周边孔的读数比内侧孔高)。
建议:实验前先让试剂回温至室温(通常25℃),孵育时将酶标板放在孵育箱中间位置,若需多次实验,尽量固定在每天同一时间段进行,减少温度波动。
2.通用试剂的适配性:别迷信万能配方
很多人觉得“ELISA 通用试剂随便用就行",但实际上,试剂与实验体系的 “适配性" 比 “通用性" 更重要。以封闭液为例,大部分实验用脱脂奶粉封闭没问题,但遇到某些特殊抗体(比如某些纳米抗体和针对糖基化位点的抗体)时,脱脂奶粉中的成分可能无法wanquan封闭酶标板空白位点,或与抗体发生非特异性结合,导致背景信号飙升、检测灵敏度下降。此外,基础缓冲液与显色液:PBS、CB、二抗、显色液等,也可能存在批次失效或体系不兼容的问题。比如PBS存放过久pH值偏移,会影响抗原-抗体结合;显色液过期则会导致显色变浅,读数偏低。
娜连生物建议:当实验出现多次非预期结果(如背景高、标曲线性差)时,别只排查抗原抗体,先对所有试剂做交叉验证,排除试剂适配性问题。

扫码加微信
 服务热线
服务热线
 上海市奉贤区南行港路2900号1幢一层
上海市奉贤区南行港路2900号1幢一层
 718497202@qq.com
718497202@qq.com
Copyright © 2026上海娜连生物科技有限公司 All Rights Reserved 备案号:沪ICP备2025116180号-3
技术支持:化工仪器网 管理登录 sitemap.xml